Lentivirus human immunodeficiency virus 2
Phylum: Non assegnato
Subphylum:
Classe:
Ordine: Gruppo VI (ssRNA-RT)
Famiglia: Retroviridae
Genere: Lentivirus
Italiano: AIDS
English: AIDS
Français: SIDA
Deutsch: AIDS
Español: SIDA
Descrizione
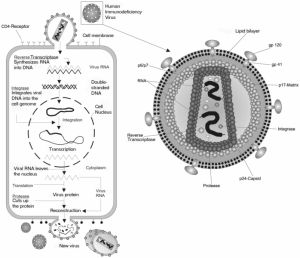
Il virus dell'immunodeficienza umana (HIV, acronimo dall'inglese Human Immunodeficiency Virus) è il virus responsabile della sindrome da immunodeficienza acquisita (AIDS). È un retrovirus del genere lentivirus. In base alle conoscenze attuali, HIV è suddiviso in due ceppi: HIV-1 ed HIV-2. Il primo dei due è prevalentemente localizzato in Europa, America ed Africa centrale. HIV-2, invece, si trova per lo più in Africa occidentale ed Asia e determina una sindrome clinicamente più moderata rispetto al ceppo precedente. Il virione di HIV ha un diametro di circa 100 nm e presenta un capside con forma icosaedrica ed un peplos che ospita le proteine di membrana virali gp120 e gp41. Il materiale genetico del virione è costituito da due copie di RNA a polarità positiva, le quali sono legate a due proteine basiche del peso, rispettivamente, di 7 e 9 kDa (denominate p7 e p9). Tale complesso, insieme alla trascrittasi inversa (una DNA polimerasi RNA-dipendente), alla proteasi ed all'integrasi è contenuto in una sezione centrale della particella virale denominata core. Esso presenta una struttura cilindro/conica ed è costituito completamente da una sola proteina (p24). Tra il core e l'involucro lipoproteico si trova uno strato di materiale elettrondenso costituito completamente dalla proteina virale p17 miristilata. Si noti che la miristilazione è un fenomeno importante per la successiva interazione della p17 con la membrana cellulare al fine di dare avvio alla gemmazione. Come tutti i retrovirus HIV possiede i tre geni fondamentali per la sua replicazione: Gag, Pol ed Env. Gag codifica per le proteine del core del virione: p24, p17, p9, p7. Da Pol derivano la trascrittasi inversa, la proteasi e l'integrasi mentre Env codifica per le proteine dell'involucro esterno. Sia Gag che Pol sono trascritti in un mRNA che viene poi tradotto in una proteina di 180 kDa (p180) che viene poi clivata tramite proteolisi. La sua scissione determina la formazione della proteasi (p10), della trascrittasi inversa (p51/p66), della integrasi e di una proteina di 55 kDa (p55). Dalla p55, sempre per proteolisi, derivano la p17, la p24 e la p15. La p15 è il progenitore della p9 e della p7, anch’esse ottenute tramite l'intervento della proteasi. Env viene tradotto in una proteina di 88 kDa che viene successivamente glicosilata ed a seguito di ciò il suo peso molecolare aumenta fino a 160 kDa (p160). Essa viene scissa, attraverso la proteasi virale, a formare le due glicoproteine legate alla membrana esterna: la gp120 e la gp41. La gp41 è una proteina transmembrana con l'estremo NH2 localizzato all'interno del virione mentre la parte COOH è esterna e serve come punto di legame per la gp120. Oltre a questi geni, HIV contiene altri sette geni accessori che hanno funzioni regolatorie del ciclo virale e della sintesi proteica: Tat, Rev, Nef, Vpr, Tev, Vif, Vpu (quest'ultimo nel genoma di HIV-2 non esiste e ve n'è un altro chiamato Vpx). Agli estremi si trovano due sequenze (dette long terminal repeats, LTR) contenenti elementi regolatori dell'espressione genica. In esse infatti si rinvengono regioni di legame per fattori sia di origine virale che cellulare i quali possono così aumentare od inibire il livello di trascrizione del genoma. Nei LTR si ritrovano siti di poliadenilazione, per il legame di fattori di trascrizione come SP1 e NF-kß, la sequenza regolatrice TATA, la sequenza di transattivazione, dove si va a legare la proteina Tat, ed anche zone con elementi regolatrori inibenti (RN, regolazione negativa). Il gene Tat, composto di due esoni, codifica per una proteina di 14.15 kDa con funzione di transattivatore che, in collaborazione con un fattore cellulare, è in grado di intensificare l'espressione dei geni virali. La sua azione si esplica tramite il legame ad una regione dei LTR definita TAR (trans-active region). Si ritiene che con la sua azione sia in grado di aumentare la trascrizione dei geni virali di circa 1000 volte. Rev è essenziale per la trascrizione dei geni Gag, Pol ed Env. Sembra, infatti, che essa sia in grado di agire su Env a livello post-trascrizionale legandosi ad una metà del gene sbloccando così la traduzione precedentemente inibita da fattori cellulari legatisi. Probabilmente l'azione a livello di Pol e Gag è simile. Sembrerebbe pure che sia in grado di inibire lo splicing del gene Env. Il gene Nef codifica per una proteina di 27 kDa capace di legare il GTP, dotata di attività GTP-asica, suscettibile di miristilazione e fosforilazione. Essa esplica un'azione inibitrice delle trascrizione legandosi alla regione RN dei LTR. Vpr codifica per una proteina di 15 kDa (p15) che si ritrova associata al virione. Si sospetta che essa sia coinvolta nella riattivazione del virus in corso di infezione latente. Altri dati, inoltre, fanno supporre una sua possibile partecipazione nell'infezione di cellule a bassa proliferazione (come i macrofagi) e nel blocco del ciclo cellulare nella fase G2 al fine di favorire l'attività dei LTR. Per quanto riguarda i geni rimanenti sembrerebbe che: Vif sia importante per l'infettività del virione. Si è visto, inoltre, che vif interagisce con una citidina deaminasi cellulare prevenendone la sua inclusione all'interno del virione in formazione ed evitando che essa possa danneggiarne il materiale genetico - Vpu intervenga nella maturazione e liberazione del virus. Pare che abbia anche la funzione di degradare la proteina CD4 all'interno del reticolo endoplasmatico. La funzione del gene Tev è ancora ignota. Il genoma di HIV è ricco di zone di sovrapposizione. Ciò avviene non solo tra geni codificanti ma anche tra questi ultimi e varie regioni regolatorie. I genomi di HIV-1 e HIV-2 differiscono, come espresso precedentemente, nei geni Vpu e Vpx. In HIV-2, infatti, il primo manca e viene sostituito dal secondo. Quest’alta presenza di embricature nel genoma fa sì che ogni proteina possa venir sintetizzata solamente a seguito di complessi fenomeni di splicing alternativo. Di HIV-1 è nota la sua estrema variabilità. Esso viene diviso in due gruppi. Il primo, definito M, viene ulteriormente suddiviso in otto sottotipi i quali differiscono nei geni env per il 30% e gag per il 14%. Il secondo gruppo, indicato con O, è raro e si ritrova in Camerun. In generale in Europa e in America è più diffuso il ceppo di tipo B. In Africa si ritrovano più spesso i sottotipi A, C, D ed in Asia si ritrovano quelli di tipo E, C e B. Sia HIV-1 che HIV-2 sono in grado di infettare le cellule che presentano sulla loro membrana il recettore CD4. Ai fini dell'ingresso nella cellula CD4 da solo è insufficiente ed il virus si deve legare ad un altro recettore. Queste ultime sono molecole appartenenti alla famiglia dei recettori con sette domini transmembrana accoppiati con la proteina G (seven transmembrane domain G-protein-coupled receptor). Come corecettori HIV utilizza principalmente CXCR4 (usati dai ceppi con tropismo per i linfociti T) e CCR5 (tipici del ceppo avente tropismo per i macrofagi). È la proteina gp120 a legarsi ai recettori virali. Essa è in grado di legarsi a CD4 formando un complesso la cui costante di dissociazione si aggira intorno a 4x10-9. Il legame con CD4 coinvolge tre regioni non contigue ed altamente conservate di gp120 separate da altre zone, invece, estremamente variabili. Dopo che è avvenuto il legame si avviano i fenomeni che danno luogo alla fusione tra la membrana virale e quella della cellula. Si è dimostrato, sulla base di studi mutazionali, che per il processo di fusione è importante il contributo della gp41, in particolare della sua parte N terminale e che questo processo avvenga in seguito a cambiamenti conformazionali scatenati dal legame con CD4 e, probabilmente, anche grazie all'attacco dell'ansa V3 di gp120 da parte di alcune proteasi cellulari. Queste modifiche permettono, poi, l'inserimento della sequenza N-terminale di gp41, formata da aminoacidi apolari, all'interno della membrana cellulare. Comunque sia, il processo di fusione non avviene senza il legame di gp120 ai suoi corecettori che, come accennato precedentemente, sono molecole appartenenti ai recettori per le chemochine: CXCR4 e CCR5. CCR5 è il recettore utilizzato dalle ß-chemochine RANTES, MIP-a, MIP-ß, LD78a ed LD78ß mentre CXCR4 ha come ligando naturale la chemochina SDF-1 (Stromal Derived Factor 1). Il legame del virus ad uno od all'altro di questi recettori permette di dividere i ceppi di HIV in R5-using e X4-using i quali utilizzano, rispettivamente il CCR5 e il CXCR4 per entrare nella cellula. Il legame di gp120 ai suoi coreccettori sembra che avvenga cronologicamente dopo quello al CD4. Si è visto che HIV è in grado di infettare produttivamente i seguenti tipi cellulari: linfociti, macrofagi, cellule della microglia e cellule dendritiche. Da alcuni esperimenti si è avanzata l'ipotesi che esso possa infettare anche i timociti ed i precursori midollari forse appartenenti alla linea mieloide-monocitica. Anche gli astrociti subiscono l'infezione da parte di HIV sebbene essa non sia produttiva. Al momento non è dimostrato che anche i neuroni possano venir infettati dal virus. Dopo che il virus è penetrato nella cellula il suo RNA viene trascritto come DNA ad opera della trascrittasi inversa e successivamente viene integrato nel genoma della cellula ospite dall'integrasi virale. Una volta che il genoma virale si è integrato in quello dell'ospite può rimanere inattivo dal punto di vista trascrizionale per un periodo di tempo compreso tra mesi ed anni. L'input che dà l'avvio alla trascrizione del genoma virale si suppone sia costituito dall'insieme di stimoli che possono attivare la cellula infetta: antigeni, citochine o anche infezioni da parte di altri virus. Ciò avviene in quanto la trascrizione dei geni di HIV è strettamente dipendente da quella dei linfociti infetti. Ciò è stato confermato da vari esperimenti nei quali si è visto che la stimolazione di linfociti o macrofagi infetti con diversi tipi di citochine è in grado di favorire la trascrizione dei geni virali nonché quelli della cellula ospite. Ciò probabilmente avviene attraverso la mediazione di fattori di trascrizione dei quali uno dei più coinvolti sembra essere NF-kß. In effetti citochine quali IL-6 e TNF-a sono in grado di stimolare i fenomeni di trascrizione genica ed anche di attivare ed aumentare la quota di tale fattore. L'espressione dei geni virali viene divisa in due fasi: precoce e tardiva. Nella prima vengono espressi i geni regolatori mentre nella seconda quelli strutturali. I geni regolatori, di cui i più noti sono Tat, Nef e Rev e la cui sintesi avviene nel citoplasma grazie ad eventi di splicing molteplici, consentono l'amplificazione della trascrizione genica ad opera della RNA polimerasi cellulare di tipo II e la stabilizzazione degli RNA messaggeri creati successivamente. Nella fase tardiva avviene la sintesi dei geni strutturali i cui trascritti vengono portati nel citoplasma e lì sottoposti ad un solo splicing ed infine tradotti in proteine. È a questo livello che interviene la proteina rev che, come espresso precedentemente, si lega ai trascritti e ne facilita il trasporto nel citoplasma. Quando la sintesi viene completata le varie proteine strutturali si assemblano tra di loro determinando la formazione delle particelle virali che vengono poi rivestite da un envelope lipoproteico. Il virus presenta diverse modalità di trasmissione: sessuale; ematica; verticale (madre-figlio). La più diffusa (85%) è quella sessuale seguita dal contatto con sangue o emoderivati infetti. Nei paesi in via di sviluppo particolarmente importante è la trasmissione verticale; questa può avvenire sia durante la gravidanza per passaggio trans-placentare (20-40%), sia durante il parto (40-70%) ed infine nell'allattamento (15-20%). Vanno infine ricordati i rischi derivanti dall'uso di materiale medico-dentistico non sterilizzato e dal contatto del personale sanitario o di laboratorio con campioni infetti. Il virus è propagabile in modo verticale attraverso il contagio madre-figlio. Per lo più si ritiene che ciò avvenga nel periodo perinatale, in particolare al momento del parto durante il quale il bambino può entrare in contatto col sangue materno durante il tragitto nel canale del parto. Tuttavia sono stati anche registrati casi limitati in cui l'infezione era già avvenuta nel primo o secondo trimestre. Al fine di ovviare al possibile contagio si è ricorso al parto cesareo che ha dimostrato una riduzione importante del rischio di trasmissione al bambino. Sono stati messi anche a punto dei protocolli con la zidovudina da assumere dopo il secondo trimestre e che hanno anch’essi dimostrato una sensibile diminuzione del tasso di trasmissione dal 22,6% al 7%. Si è anche documentata la possibilità di infezione madre-figlio attraverso il latte od il colostro materni ed effettivamente il virus si può ritrovare in entrambi i fluidi. Questo comporta l'avvertenza di evitare l'allattamento al seno per tutte le madri contagiate dal virus. Ciò comporta dei problemi soprattutto nei Paesi in via di sviluppo in cui l'allattamento materno è spesso l'unica fonte di sopravvivenza e di protezione dalle infezioni per il neonato.

|
Data: 01/01/2003
Emissione: Lotta all'AIDS Stato: Rwanda |
|---|

|
Data: 08/02/2003
Emissione: Giornata della lotta all'AIDS Stato: Solomon Islands |
|---|

|
Data: 01/12/2002
Emissione: Lotta all'AIDS Stato: Botswana |
|---|

|
Data: 01/12/2002
Emissione: Lotta all'AIDS Stato: Botswana |
|---|

|
Data: 01/12/2002
Emissione: Lotta all'AIDS Stato: Botswana |
|---|

|
Data: 01/12/2002
Emissione: Lotta all'AIDS Stato: Botswana |
|---|
|
Data: 01/01/2011
Emissione: Lotta all'AIDS Stato: Rwanda |
|---|

|
Data: 04/12/2002
Emissione: 100° anniversario della fondazione dell'Associazione Panamericana per la Salute Stato: Barbados |
|---|

|
Data: 22/12/2003
Emissione: Lotta all'AIDS Stato: Ivory Coast |
|---|

|
Data: 22/12/2003
Emissione: Lotta all'AIDS Stato: Ivory Coast |
|---|
|
Data: 06/05/1994
Emissione: Lotta all'AIDS Stato: Spanish Andorra |
|---|

|
Data: 01/01/2003
Emissione: Lotta all'AIDS Stato: Rwanda |
|---|

|
Data: 01/01/2003
Emissione: Lotta all'AIDS Stato: Rwanda |
|---|

|
Data: 01/01/2003
Emissione: Lotta all'AIDS Stato: Rwanda |
|---|